PlantBiotech:Species/Solanum lycopersicum
From Metabolomics.JP
(Difference between revisions)
| (84 intermediate revisions by 2 users not shown) | |||
| Line 1: | Line 1: | ||
| + | {{PlantBiotech/Header}} | ||
| + | {| style="float:right" | ||
| + | |__TOC__ | ||
| + | |} | ||
| + | |||
==トマト遺伝子導入実験プロトコール== | ==トマト遺伝子導入実験プロトコール== | ||
| − | + | {| | |
| + | | | ||
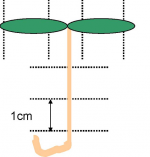
| + | ||[[Image:Horticulture-Solanum-lycopersicum-001.png|250px]] | ||
| + | | | ||
| + | 2005. 6/27 改正版 | ||
| + | |} | ||
| − | + | ==形質転換スケジュール== | |
| + | {| | ||
| + | ||[[Image:Horticulture-Solanum-lycopersicum-002.png|300px]] | ||
| + | |} | ||
| − | === | + | ==実験プロトコール== |
| − | + | ||
| − | + | ||
===滅菌=== | ===滅菌=== | ||
| − | + | <center> | |
| − | + | <gallery perrow="4"> | |
| + | Image:Horticulture-Solanum-lycopersicum-003.png|700 mg/300 粒 | ||
| + | Image:Horticulture-Solanum-lycopersicum-004.png|70 % EtOH 2 分振とう | ||
| + | Image:Horticulture-Solanum-lycopersicum-005.png| | ||
| + | Image:Horticulture-Solanum-lycopersicum-006.png|1 % 次亜塩+ 200 μl/L tween 10 分振とう | ||
| + | </gallery> | ||
| + | </center> | ||
===洗浄=== | ===洗浄=== | ||
| − | + | クリーンベンチ作業 | |
| − | + | <center> | |
| + | <gallery perrow="3"> | ||
| + | Image:Horticulture-Solanum-lycopersicum-007.png|洗浄前 | ||
| + | Image:Horticulture-Solanum-lycopersicum-008.png|SDWで 1 分間× 5 回洗浄 | ||
| + | Image:Horticulture-Solanum-lycopersicum-009.png|洗浄後 | ||
| + | </gallery> | ||
| + | </center> | ||
| + | ;point | ||
| + | * 種子の沈殿が洗浄の目安。洗浄が甘いと発芽が悪くなる。 | ||
===播種=== | ===播種=== | ||
| − | + | クリーンベンチ作業 | |
| − | + | <center> | |
| + | <gallery perrow="3"> | ||
| + | Image:Horticulture-Solanum-lycopersicum-010.png|1/2 MS+3 % Suc+ 0.8 % Agar pH 5.8 25 ℃, 16 h 日長で培養 | ||
| + | Image:Horticulture-Solanum-lycopersicum-011.png|50-60 粒/7 cm <br>マヨネーズ瓶 | ||
| + | Image:Horticulture-Solanum-lycopersicum-012.png|50 粒播種するとこんな感じ<br>→約 1 週間培養 | ||
| + | </gallery> | ||
| + | </center> | ||
===前培養=== | ===前培養=== | ||
| + | クリーンベンチ作業 | ||
| + | <center> | ||
| + | {| | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-013.png|150px|thumb|作業は湿らせたろ紙の上で子葉を傷つけないように<br>胚軸は下の方を使う<br>子葉の両端を切る]] | ||
| + | |→湿らしたろ紙へ一時置き→ | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-014.png|200px|thumb|MS+ 2 mg/l Zeatin+ 3 % Suc+0.8 % Agar<br>48 切片/1シャーレ(9cm深底シャーレ)<br>パラフィルムでシール<br>→ 2 日間, 25 ℃, 16 h 日長で培養]] | ||
| + | |} | ||
| + | </center> | ||
| + | ;point | ||
| + | * 本葉が出たものはNG。 | ||
| + | * 作業中乾かないように注意!! | ||
| + | * 子葉は必ず背軸面が培地に触れるように置床。 | ||
| − | + | ===アグロバクテリウムの調整=== | |
| − | + | ; 前培養; | |
| − | + | : LBプレート(+抗生物質)にグリセロールストックのアグロバクテリウムをストリーク | |
| − | + | : ↓2 日間 28 ℃,暗所 | |
| − | + | : | |
| − | + | ; 感染用培養; | |
| − | + | : シングルコロニーをLBプレート(+抗生物質)にストリーク | |
| − | + | : ↓2 日間 28 ℃,暗所 | |
| − | + | : | |
| − | + | ;point | |
| − | + | * 必ず増殖中(盛り上がる前)の菌プレートを用意する。 | |
| − | + | * 導入した遺伝子によって増殖速度が微妙に異なるため、培養時間をずらしたプレートを何枚か準備と良い。 | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | ; | + | |
| − | : | + | |
| − | + | ||
| − | : | + | |
| − | + | ||
| − | + | ||
| − | : | + | |
| − | + | ||
| − | + | ||
| − | ; | + | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ===感染=== | |
| + | ;注)改善の余地あり | ||
| + | <center> | ||
| + | <gallery perrow="5"> | ||
| + | Image:Horticulture-Solanum-lycopersicum-015.png|菌液の準備;<br>MS液体培地 50 ml +アセトシリンゴン(10 mg/L) スパールで集菌し、ピペッティング | ||
| + | Image:Horticulture-Solanum-lycopersicum-016.png|切片を滅菌した茶漉しに入れ<br>菌液内で 1 分間攪拌 | ||
| + | Image:Horticulture-Solanum-lycopersicum-017.png|滅菌したキムタオルで<br>水分除去 | ||
| + | Image:Horticulture-Solanum-lycopersicum-018.png|さらに水分除去 | ||
| + | Image:Horticulture-Solanum-lycopersicum-014.png|元の培地に<br>(3 日間, 21 ℃,遮光) | ||
| + | </gallery> | ||
| + | </center> | ||
| − | + | ===除菌=== | |
| + | ;注)改善の余地あり | ||
| + | : 洗浄:MS液体培地 | ||
| + | : 除菌:MS液体培地+Cb 500 mg/l | ||
| + | <center> | ||
| + | <gallery perrow="2"> | ||
| + | Image:Horticulture-Solanum-lycopersicum-016.png|2,3 分ゆすりながら洗う<br>洗浄 1 回/除菌 1 回 | ||
| + | Image:Horticulture-Solanum-lycopersicum-017.png|水分除去→選抜へ<br>(2 週間, 25 ℃, 16 h 日長) | ||
| + | </gallery> | ||
| + | </center> | ||
| + | ;point | ||
| + | * 傷をつけないように気をつける。 | ||
| − | * | + | ===選抜=== |
| + | {| | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-014.png|150px]] | ||
| + | | | ||
| + | ; 選抜1,2回目(カルス誘導) | ||
| + | : カルス誘導培地:MS+ 2 mg/l Zeatin+抗生物質+ 250 mg/l Cb+ 3 % Suc+0.8 % Agar | ||
| + | ; point | ||
| + | * サージカルテープでシール(選抜 1)。 | ||
| + | * パラフィルムでシール(選抜 2)。 | ||
| + | * 24切片/1シャーレ子葉は表面を上に、少し培地に埋め込む。 | ||
| + | |- | ||
| + | | | ||
| + | | | ||
| + | ; 選抜3回目(再分化誘導) | ||
| + | : 再分化誘導培地 MS+ 1 mg/l Zeatin+抗生物質+ 250 mg/l Cb+ 3 % Suc+ 0.8 % Agar | ||
| + | ; point | ||
| + | * パラフィルムでシール。 | ||
| + | * 1シャーレあたり 20切片以下。 | ||
| + | * 3回目の選抜ではカルスの反対側の切片を切り落とす。 | ||
| + | |- | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-019.png|150px]] | ||
| + | | | ||
| + | ; 選抜4回目(シュート伸長・発根) | ||
| + | : シュート伸長・発根誘導培地:MS+ 1 mg /lIBA+抗生物質+ 125 mg/lCb+ 3% Suc+ 0.8 % Agar | ||
| + | : カルス化した切片をマヨネーズ瓶に移す | ||
| + | : | ||
| + | |- | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-020.png|150px]] | ||
| + | | | ||
| + | ; 選抜5回目(発根) | ||
| + | : 発根誘導培地:MS+ 0.5 mg /lIBA+抗生物質+ 125 mg/lCb+ 3% Suc+ 0.8 % Agar | ||
| + | ; point | ||
| + | * シュートの条件:発根したカルスから取る。大きさ( 2cm程度。 | ||
| + | * 発根を阻害されるのでカルスはきれいに取り除く。 | ||
| + | * アグロとエスケープを防ぐため、少なくとも3回は頂芽を植継ぐ。 | ||
| + | * 花芽は切り落とす!! | ||
| + | |} | ||
| − | + | ===馴化=== | |
| + | <center> | ||
| + | {| | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-020.png|150px|thumb|]] | ||
| + | | → | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-021.png|150px|thumb|]] | ||
| + | |} | ||
| + | </center> | ||
| + | ; point | ||
| + | * 根を傷つけない | ||
| + | * ロックウールに馴化した苗を容器に入れサランラップで覆い、 1 週間程度かけてサランラップをあけて湿度を下げていく。 | ||
| + | * 土でも馴化できるが、湿度には十分注意する。 | ||
| + | * 水やりは最初の 2 週間は水のみ、その後 1000 倍ハイポネックッス/週 1。 | ||
| − | Screening for highly active | + | ===効率=== |
| + | ; 植物形質転換用バイナリーベクター | ||
| + | : Liu et al. (1999) Proc. Natl. Acad. Sci. USA.; 96: 6535-6540 | ||
| + | {| | ||
| + | |[[Image:Horticulture-Solanum-lycopersicum-022.png|200px]] | ||
| + | | | ||
| + | ; (平均インサート長:80 Kb) | ||
| + | : 1ベクターあたり | ||
| + | : 感染:240 切片 | ||
| + | : 馴化できた系統数: 0-21 系統作出 | ||
| + | |} | ||
| + | ; point | ||
| + | * カルベニシリンよりMeropenemの方がアグロバクテリウムの増殖を抑えるとの報告もあります!! | ||
| + | : Yoichi Ogawa, Masahiro Mii (2004) Arch Microbiol; 181: 331-336 | ||
| + | : Screening for highly active β-lactam antibiotics against Agrobacterium tumefaciens | ||
Latest revision as of 16:04, 1 September 2011
| トップページ | イネ | ミヤコグサ | トマト | ダイズ | 培地一覧 |
|
[edit] トマト遺伝子導入実験プロトコール

|
2005. 6/27 改正版 |
[edit] 形質転換スケジュール
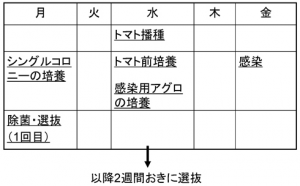
|
[edit] 実験プロトコール
[edit] 滅菌
[edit] 洗浄
クリーンベンチ作業
- point
- 種子の沈殿が洗浄の目安。洗浄が甘いと発芽が悪くなる。
[edit] 播種
クリーンベンチ作業
[edit] 前培養
クリーンベンチ作業
| →湿らしたろ紙へ一時置き→ |
- point
- 本葉が出たものはNG。
- 作業中乾かないように注意!!
- 子葉は必ず背軸面が培地に触れるように置床。
[edit] アグロバクテリウムの調整
- 前培養;
- LBプレート(+抗生物質)にグリセロールストックのアグロバクテリウムをストリーク
- ↓2 日間 28 ℃,暗所
- 感染用培養;
- シングルコロニーをLBプレート(+抗生物質)にストリーク
- ↓2 日間 28 ℃,暗所
- point
- 必ず増殖中(盛り上がる前)の菌プレートを用意する。
- 導入した遺伝子によって増殖速度が微妙に異なるため、培養時間をずらしたプレートを何枚か準備と良い。
[edit] 感染
- 注)改善の余地あり
[edit] 除菌
- 注)改善の余地あり
- 洗浄:MS液体培地
- 除菌:MS液体培地+Cb 500 mg/l
- point
- 傷をつけないように気をつける。
[edit] 選抜
[edit] 馴化
| → |
- point
- 根を傷つけない
- ロックウールに馴化した苗を容器に入れサランラップで覆い、 1 週間程度かけてサランラップをあけて湿度を下げていく。
- 土でも馴化できるが、湿度には十分注意する。
- 水やりは最初の 2 週間は水のみ、その後 1000 倍ハイポネックッス/週 1。
[edit] 効率
- 植物形質転換用バイナリーベクター
- Liu et al. (1999) Proc. Natl. Acad. Sci. USA.; 96: 6535-6540

|
|
- point
- カルベニシリンよりMeropenemの方がアグロバクテリウムの増殖を抑えるとの報告もあります!!
- Yoichi Ogawa, Masahiro Mii (2004) Arch Microbiol; 181: 331-336
- Screening for highly active β-lactam antibiotics against Agrobacterium tumefaciens