Aritalab:Lecture/Biochem/Amino Acid
| Line 53: | Line 53: | ||
==アミノ酸の種類と特徴== | ==アミノ酸の種類と特徴== | ||
| − | {{ | + | {{Aritalab:Lecture/Biochem/Amino Acid/Table}} |
| − | {{ | + | {{Aritalab:Lecture/Biochem/Amino Acid/DL}} |
Revision as of 12:41, 2 June 2011
Contents |
酸と塩基
- アレニウスの定義
アレニウス(Arrhenius)は、酸と塩基をそれぞれ、水に溶けてプロトンH+、OH-を生じる物質と定義しました。しかし、この定義では水に溶けない物質は酸なのか、塩基なのかがわかりません。
- ブレンステッドの定義
ブレンステッド(Broensted)は以下のように酸と塩基を定義しました。
- 酸… プロトンを与える物質
- 塩基…プロトンを受け取る物質
これはアレニウスの定義の素直な拡張になっています。水に溶けてプロトンが生じる場合、HA → H+ + A-という反応が水中で生じています。このとき HA はプロトンを与えるので酸です。逆にA-イオンは塩基になります。 プロトン自身は電子を与えられず、どの物質に対しても酸として働く物質になります。プロトンを持つ物質は、反応する相手により酸にも塩基にもなれます。つまり、酸とか塩基とかは相対的な指標なのです。しかし、この定義をもってしても水素を含まない物質に関しては酸と塩基の定義ができません。
- ルイスの定義
ブレンステッドの定義と同年、ルイス(Lewis)はさらに一般的な定義を出しました。
- 酸… 電子を受け取る物質
- 塩基…電子を与える物質
ブレンステッドの定義では、プラスの電荷(プロトン)を与えるものが酸でした。プラスの電荷を与えることは、電荷の収支を考えるとマイナスの電荷を得ること、つまり電子を受け取る事と同じ意味になります。
たとえば、(プロトンを含む)正のイオンは電子を受け取れるので酸であり、負のイオンは塩基となります。また、イオンでなくてもアルコールなど非共有電子対(化学結合に関与しない電子対)をもつ物質は、塩基となります。
弱酸と弱塩基
水溶液中で一部だけイオンになるような酸と塩基をそれぞれ弱酸、弱塩基とよびます。生体における代表例は以下のとおりです。
- 弱酸… 酢酸、ギ酸などの有機酸、リン酸
- 弱塩基…アミン類
アミン類とはR-NH2の形で表される化学基で、水中でR-NH3+の形をとります。プロトンを受け取るので塩基です。
アミノ酸 = アミン + 酸
アミノ酸は、アミノ基 (-NH2) とカルボキシル基 (-COOH) の両方を持っています。このため、酸とも塩基とも反応でき、両性電解質とよばれます。中性のpHにおいてはどちらの基もイオンになった両性イオン (zwitterion) になると考えられています。その電荷は溶液の pH によって変化し、ちょうど0になるような溶液のpHを等電点 (isoelectric point, pI) と呼びます。
通常のアラニン 両性イオンのアラニン COOH COO- | | H-C-NH2 H-C-NH3+ | | CH3 CH3
両性イオンであることは、さまざまなメリットがあります。
- 水によく溶け、非極性の有機溶媒には溶けにくい。
- アミノ基とカルボキシル基が脱水縮合して結合し、ポリマーを作れる。
このアミノ酸のポリマーが、いわゆる、たんぱく質です。たんぱく質は20種類のアミノ酸で構成されます。
アミノ酸の種類と特徴
| ID | Code | Symbol | 構造 | 特徴 | pI | 必須アミノ酸? |
|---|---|---|---|---|---|---|
| L-Alanine | Ala | A | -CH3 | neutral | 6.0 | |
| L-Serine | Ser | S | -CH2OH | neutral | 5.7 | |
| L-Threonine | Thr | T | -CH(OH)CH3 | neutral | 5.6 | yes |
| L-Valine | Val | V | -CH(CH3)2 | neutral, branched | 6.0 | yes |
| L-Leucine | Leu | L | -CH2CH(CH3)2 | neutral, branched | 6.0 | yes |
| L-Isoleucine | Ile | I | -CH(CH3)CH2CH3 | neutral, branched | 6.0 | yes |
| L-Aspartate | Asp | D | -CH2COOH | acidic | 2.8 | |
| L-Glutamate | Glu | E | -CH2CH2COOH | acidic | 3.2 | |
| L-Asparagine | Asn | N | -CH2CONH2 | acidic, amido | 5.4 | |
| L-Glutamine | Gln | Q | -CH2CH2CONH2 | acidic, amido | 5.7 | |
| L-Lysine | Lys | K | -(CH2)4NH3 | basic | 9.7 | yes |
| L-Arginine | Arg | R | -(CH2)3NHC(=NH)NH2 | basic | 10.8 | |
| L-Cysteine | Cys | C | -CH2SH | neutral, S | 5.1 | |
| L-Methionine | Met | M | -(CH2)2SCH3 | neutral, S | 5.7 | yes |
| L-Phenylalanine | Phe | F | -CH2-Benz | neutral, aromatic | 5.5 | yes |
| L-Tyrosine | Tyr | Y | -CH2-Benz-OH | neutral, aromatic | 5.7 | |
| L-Tryptophan | Trp | W | -CH2-Indole | neutral, aromatic | 5.9 | yes |
| L-Histidine | His | H | -CH2-Imidazole | basic, atomatic | 7.6 | yes |
| L-Proline | Pro | P | -NH-(CH2)3- | neutral, cyclic, 2nd amine | 6.2 |
Definition
Except for glycine, an amino acid contains a chiral carbon, distinguished by D or L (R or S). In the Fischer projection, which places the carboxyl group upward and amino acid-specific side-chain downward, the amino group must comes either left or right, protruding from the paper plane. If the hydrogen is left and amino group is right, the amino acid is called D, after D-glyceraldehide. If the amino group is left, it is called L.
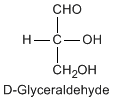
|
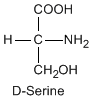
|
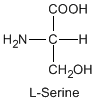
|
DL and RS do not coincide
In the Cahn-Ingold-Prelog (or RS) notation, 19 L-amino acids become S-form (when H is placed behind the paper plane, the amino group, carboxyl group and side chain are arranged anticlockwise). Only L-cysteine becomes R-form because S in its side chain makes the arrangement in the different order: amino group, side chain, and carboxyl group. For this reason, although its tetrahedal configuration is the same as the rest of amino acids, it is R-form. Likewise, cystine is R-form too.
Glycine has no chiral carbon
Glycine has two Hydrogen branches and therefore not chiral. The amino group of proline is included in the ring sturucture and therefore secondary amine.