Aritalab:Lecture/Bioinformatics/Protein
m (Created page with "==タンパク質の構造計算== ===構造比較の尺度 RMSD=== RMSD (root mean square deviation) は二つの点集合 <math>X = { x_1, x_2, \cdots, x_N} </math> と <math...") |
m |
||
| Line 1: | Line 1: | ||
| − | |||
| − | |||
===構造比較の尺度 RMSD=== | ===構造比較の尺度 RMSD=== | ||
RMSD (root mean square deviation) は二つの点集合 | RMSD (root mean square deviation) は二つの点集合 | ||
| Line 11: | Line 9: | ||
例えば PDB に登録されている二つのタンパク質の構造類似度を測るには、ポリペプチドのC<sub>α</sub> 座標群を回転・平行移動させてできるだけ重ね合わせたときの RMSD を用います。 | 例えば PDB に登録されている二つのタンパク質の構造類似度を測るには、ポリペプチドのC<sub>α</sub> 座標群を回転・平行移動させてできるだけ重ね合わせたときの RMSD を用います。 | ||
| − | |||
===Ab Initio構造予測=== | ===Ab Initio構造予測=== | ||
| Line 21: | Line 18: | ||
===分子の力場=== | ===分子の力場=== | ||
| + | |||
タンパク質は巨大なため、構造を量子力学の立場で記述するとあまりに複雑です。 | タンパク質は巨大なため、構造を量子力学の立場で記述するとあまりに複雑です。 | ||
そのため C<sub>α</sub> 座標のみを用いた力学系で解釈する分子力学がよく使われます。 | そのため C<sub>α</sub> 座標のみを用いた力学系で解釈する分子力学がよく使われます。 | ||
| Line 49: | Line 47: | ||
===スレッディング=== | ===スレッディング=== | ||
| + | |||
あらかじめ正解の構造がデータベース中にあると仮定して、類似配列を検索する手法です。 | あらかじめ正解の構造がデータベース中にあると仮定して、類似配列を検索する手法です。 | ||
* ホモロジーモデリング ... アミノ酸が30%以上保存されるような配列を検索するのに向いています。データベースに登録された鋳型構造にあうようにアミノ酸配列を重ねあわせます。大きなサイズのタンパク質でも対応できます。 | * ホモロジーモデリング ... アミノ酸が30%以上保存されるような配列を検索するのに向いています。データベースに登録された鋳型構造にあうようにアミノ酸配列を重ねあわせます。大きなサイズのタンパク質でも対応できます。 | ||
| − | + | ||
| + | ;3D-1D法、Verify3D | ||
| + | |||
| + | 3D-1D法は、タンパク質の立体構造を考える上で20種のアミノ酸を区別する必然性は無いことに注目します。各アミノ酸に環境(極性か非極性か、タンパク質の内側か外側か)分類と二次構造のカテゴリーを割り当て、タンパク質の立体構造と一次構造の整合性を評価する指標を作ります。 | ||
Revision as of 03:57, 21 December 2011
Contents |
構造比較の尺度 RMSD
RMSD (root mean square deviation) は二つの点集合
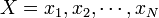 と
と
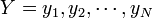 (具体的にはタンパク質を構成するポリペプチドのCα座標) の間に定義される距離の平均値という意味で、次の式であらわされます。
(具体的にはタンパク質を構成するポリペプチドのCα座標) の間に定義される距離の平均値という意味で、次の式であらわされます。
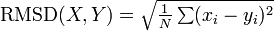
例えば PDB に登録されている二つのタンパク質の構造類似度を測るには、ポリペプチドのCα 座標群を回転・平行移動させてできるだけ重ね合わせたときの RMSD を用います。
Ab Initio構造予測
どのフォルドを取るかあらかじめ決めずに配列から構造を予測します。
- 分子力学 ... エネルギーが低くなる方向に原子を移動して最適化
- 分子動力学 ... 原子をニュートンの運動方程式に従って動かして最適化
- フラグメントアセンブリ ... 9残基など決められたウィンドウ毎に既知構造ライブラリの中から形状を切り出し、ランダムに入れ替えながら構造を最適化します。(ランダムに入れ替えるのでモンテカルロ法の一種です。) 200残基以下のタンパク質であれば、構造を大体予測できるようになってきました。
分子の力場
タンパク質は巨大なため、構造を量子力学の立場で記述するとあまりに複雑です。 そのため Cα 座標のみを用いた力学系で解釈する分子力学がよく使われます。 代表的な分子力場のモデルには CHARMM (Chemistry at Harvard using Molecular Mechanics) や AMBER (Assisted Model Building with Energy Refinement) があります。
まず分子全体のエネルギーを以下のように表します。アミノ酸 N 個の座標を 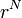 と表現します。
と表現します。
![\begin{align}
V(r^N) &= \textstyle \Big( \sum_{i} \frac{k_i}{2} (l_i - l_{i0})^2
+ \sum_{j} \frac{k_j}{2} (\theta_j - \theta_{j0})^2
+ \sum \frac{V_n}{2} ( 1 + \cos (n\omega - \gamma) ) \Big)\\
&+ \textstyle\sum_{i=1}^N \sum_{j=i+1}^N \frac{q_iq_j}{4\pi \epsilon_0 r_{ij}}\\
&+ \textstyle\sum_{i=1}^N \sum_{j=i+1}^N 4 \epsilon_{ij} \Big[ \Big( \frac{\sigma_{ij}}{r_{ij}} \Big)^{12} - \Big( \frac{\sigma_{ij}}{r_{ij}} \Big)^6 \Big]
\end{align}](/mediawiki/images/math/7/c/a/7ca902b6439deb7b047bbc9c72aa13bf.png)
最初の項は共有結合によるエネルギーです。さらに、結合距離、結合角度、結合のねじれに関するエネルギーから構成されます。
- 結合距離 (bond distance)
原子間の結合に対して定められる基準距離 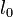 から伸縮して生成するエネルギーはフックの法則に従うと考えます。パラメータは
から伸縮して生成するエネルギーはフックの法則に従うと考えます。パラメータは 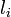 です。
です。
- 原子価角度 (valence angle)
Cα が接続する角度がねじれて生成するエネルギーも、フックの法則(二次式)に従うと考えます。同様に 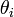 がパラメータです。
がパラメータです。
- ねじれ角
ここにおける 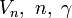 は原子の種類や配置によって決まる定数で、二面角
は原子の種類や配置によって決まる定数で、二面角 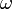 がパラメータになります。
ねじれ角のエネルギーは結合距離や原子価角度によるものより小さく、二面角は立体構造の中で柔軟に動きうる部分です。
がパラメータになります。
ねじれ角のエネルギーは結合距離や原子価角度によるものより小さく、二面角は立体構造の中で柔軟に動きうる部分です。
二項目がクーロン力で、全ての Cα 間に定義される長距離相互作用になります。電荷 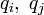 が距離
が距離 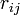 だけ0離れたときのエネルギーを計算しています。
だけ0離れたときのエネルギーを計算しています。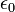 は真空の誘電率です。 最後の項は、ファンデルワールス相互作用で、 Lennard-Jones の12-6ポテンシャルという概念に従うと考えます。
は真空の誘電率です。 最後の項は、ファンデルワールス相互作用で、 Lennard-Jones の12-6ポテンシャルという概念に従うと考えます。
スレッディング
あらかじめ正解の構造がデータベース中にあると仮定して、類似配列を検索する手法です。
- ホモロジーモデリング ... アミノ酸が30%以上保存されるような配列を検索するのに向いています。データベースに登録された鋳型構造にあうようにアミノ酸配列を重ねあわせます。大きなサイズのタンパク質でも対応できます。
- 3D-1D法、Verify3D
3D-1D法は、タンパク質の立体構造を考える上で20種のアミノ酸を区別する必然性は無いことに注目します。各アミノ酸に環境(極性か非極性か、タンパク質の内側か外側か)分類と二次構造のカテゴリーを割り当て、タンパク質の立体構造と一次構造の整合性を評価する指標を作ります。